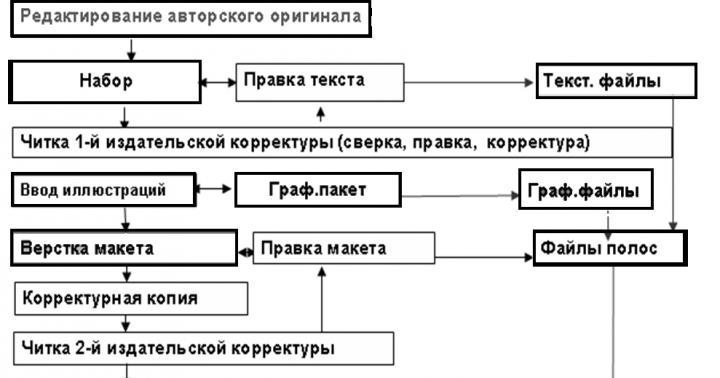
Конспект урока по физике для 10 класса
по теме «Кристаллические и аморфные тела»
Тип урока : изучение нового материала.
Цель урока: Раскрыть основные свойства кристаллических и аморфных тел. Показать применение кристаллов в технике.
Задачи
Образовательная :
сформировать у обучающихся, понятия кристалл, аморфное тело, монокристалл, поликристалл, изучить свойства кристаллов и аморфных тел.
Развивающая :
развивать познавательный интерес к предмету, наблюдательность, способность анализировать и делать выводы из наблюдаемых явлений, способность обобщать полученные результаты, навыки самостоятельной работы с информацией
Воспитательная :
формирование научного мировоззрения , воспитывать чувство самостоятельности , организованности , ответственности .
Оборудование для учителя: проектор, компьютер, интерактивная доска, презентация «Кристаллические и аморфные теля», модели кристаллических решёток, кристаллы выращенные учащимися, при подготовке к уроку, сосуд с горячей водой, видеофрагмент «Познавательное о кристаллах»
Оборудование для учащихся: коллекции минералов, линза, набор для исследования веществ (пробирка с кристаллическим веществом, пробирка с аморфным веществом, пакетик с натриевой солью, пустая пробирка термометр, секундомер), нетбуки.
План урока
Организационный момент.
Постановка цели.
Изучение нового материала.
Первичное закрепление
Рефлексия
Домашнее задание
Ход урока
Организационный момент.
Постановка цели.
«Пора чудес пришла, и нам подыскивать приходится причины всему, что совершается на свете» так писал Уильям Шекспир. В окружающем нас мире с веществами происходят различные физические и химические процессы. И, несмотря на многообразие веществ, они могут находиться только в трёх агрегатных состояниях. Сегодня на уроке вы познакомитесь с кристаллическими и аморфными телами и их свойствам.
Разделение класса на группы.
Изучение нового материала.
«...Подобен чуду рост кристалла,
Когда обычная вода,
Мгновение помедлив, стала
Сверкающим осколком льда.
Луч света, затерявшись в гранях,
Рассыплется на все цвета…
И нам тогда понятней станет,
Какой бывает красота…»
Леонтьев Павел
С древних времен кристаллы привлекали человека своей красотой. Их цвет, блеск и форма затрагивали человеческое чувство прекрасного, и люди украшали ими себя и жилище. С давних пор с кристаллами были связаны суеверия; как амулеты, они должны были не только ограждать своих владельцев от злых духов, но и наделять их сверхъестественными способностями. Украшения из кристаллов сейчас столь же популярны, как и раньше. Когда те же самые минералы стали разрезать и полировать, как драгоценные камни, многие суеверия сохранились в талисманах «на счастье» и «своих камнях», соответствующих месяцу рождения.
Кристаллы - это твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве.
Все драгоценные природные камни, кроме опала, являются кристаллическими, и многие из них, такие, как алмаз, рубин, сапфир и изумруд, попадаются в виде прекрасно ограненных кристаллов.
Для наглядного представления строения кристаллов используются кристаллические решетки. В узлах решётки располагаются центры атомов или молекул данного вещества. Атомы в кристаллах плотно упакованы, расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решёток указывается только положение центров атомов.
В каждой кристаллической решетке можно выделить элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса элементарной ячейки по некоторым направлениям. Примеры простых кристаллических решёток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемно-центрированная кубическая решетка; 4 – гексагональная решетка. Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).

Известный русский кристаллограф Евграф Степанович Фёдоров установил, что в природе может существовать только 230 различных пространственных групп, охватывающих все возможные кристаллические структуры. Большинство из них (но не все) обнаружены в природе или созданы искусственно.
Кристаллы могут иметь форму различных призм, основанием которых могут быть правильный треугольник, квадрат, параллелограмм и шестиугольник. Поэтому кристаллы имеют плоские грани. Например, крупинка обычной поваренной соли имеет плоские грани, составляющие друг с другом прямые углы. Это можно заметить, рассматривая соль с помощью лупы.
Идеальные формы кристаллов симметричны. По выражению Евграфа Степановича Фёдорова, кристаллы блещут симметрией. В кристаллах можно найти различные элементы симметрии: плоскость симметрии, ось симметрии, центр симметрии. Кристалл в форме куба (NaCl , KCl и др.) имеет девять плоскостей симметрии, тринадцать осей симметрии, кроме того, он имеет центр симметрии. Всего в кубе 23 элемента симметрии.

Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главное свойство кристаллов анизотропия - это зависимость физических свойств от выбранного в кристалле направления.
У кристаллов по разным направлениям обнаруживается различная механическая прочность. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее.

Легко расслаивается в одном направлении кристалл графита. Слои образованы рядом параллельных сеток, состоящих из атомов углерода. Атомы располагаются в вершинах правильных шестиугольников. Расстояние между слоями сравнительно велико - примерно в 2 раза больше, чем длина стороны шестиугольника, поэтому связи между слоями менее прочны, чем связи внутри них.
От направления зависят и оптические свойства кристаллов. Так, кристалл кварца по-разному преломляет свет в зависимости от направления падающих на него лучей. Многие кристаллы по-разному проводят тепло и электрический ток в различных направлениях.
Металлы имеют кристаллическую структуру. Но если взять сравнительно большой кусок металла, то его кристаллическое строение никак не проявляется, ни во внешнем виде, ни в его физических свойствах. Почему металлы в обычном состоянии не обнаруживают анизотропии?
Оказывается, металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Под микроскопом или даже с помощью лупы их нетрудно рассмотреть, особенно на свежем изломе металла. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению друг к другу беспорядочно. В результате все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.

Одиночные кристаллы - монокристаллы имеют правильную геометрическую форму, и их свойства различны по разным направлениям.
Твердое тело, состоящее из большого числа маленьких кристалликов, называют поликристаллом. Большинство кристаллических тел - поликристаллы, так как они состоят из множества сросшихся кристаллов.
Просмотр видео «Познавательное о кристаллах»
Задание № 1 работа в группах
Рассмотрите коллекцию минералов. Запишите название минералов имеющих кристаллическое строение.
Задание № 2 работа в группах
Свойства кристаллов используется в различных устройствах и приборах. Вам необходимо изучить информацию о применении кристаллов. И записать результаты работы в таблицу.
Используют нетбуки или раздаются карточки. «Приложение 1»
Мы живем на поверхности твердого тела – земного шара, в сооружениях, построенных из твердых тел. Орудия труда, машины также сделаны из твердых тел. Но не все твёрдые тела – кристаллы. Кроме кристаллических тел существуют - аморфные тела. Примером аморфных тел являются смола, стекло, канифоль, сахарный леденец и др.
Часто одно и то же вещество может находиться как в кристаллическом, так и в аморфном состоянии. Например, кварц SiO 2 может быть как в кристаллической, так и в аморфной форме (кремнезем). У аморфных тел нет строгого порядка в расположении атомов. Только ближайшие атомы-соседи располагаются в некотором порядке По расположению атомов и по их поведению аморфные тела аналогичны жидкостям.
Кристаллическую форму кварца схематически можно представить в виде решетки из правильных шестиугольников. Аморфная структура кварца также имеет вид решетки, но неправильной формы. Наряду с шестиугольниками в ней встречаются пяти- и семиугольники. Аморфные тела – это твёрдые тела, где сохраняется только ближний порядок в расположении атомов. «Слайд 14»

Задание № 3 работа в группах
С помощью тренажёра рассортировать вещества и определить их принадлежность к кристаллам или аморфным телам.
Все аморфные тела изотропны, т. е. их физические свойства одинаковы по всем направлениям. При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства, подобно твердым телам, и текучесть, подобно жидкости. Так, при кратковременных воздействиях (ударах) они ведут себя как твердые тела и при сильном ударе раскалываются на куски. Но при очень продолжительном воздействии аморфные тела текут. В этом вы можете убедиться сами, если запасетесь терпением. Проследите за куском смолы, который лежит на твердой поверхности. Постепенно смола по ней растекается, и, чем выше температура смолы, тем быстрее это происходит.
С течением времени некристаллическое вещество может «переродиться», или, точнее, закристаллизоваться, частицы в них собираются в правильные ряды. Только срок для разных веществ различен: для сахара это несколько месяцев, а для камня - миллионы лет. Пусть леденец полежит спокойно месяца два-три. Он покроется рыхлой корочкой. Посмотрите на нее в лупу: это мелкие кристаллики сахара. В некристаллическом сахаре начался рост кристаллов. Подождите еще несколько месяцев - и уже не только корочка, но и весь леденец закристаллизуется. Даже наше обыкновенное оконное стекло может закристаллизоваться. Очень старое стекло становится иногда совершенно мутным, потому, что в нем образуется масса мелких непрозрачных кристаллов.
Аморфные тела при низких температурах по своим свойствам напоминают твердые тела. Текучестью они почти не обладают, но по мере повышения температуры постепенно размягчаются и их свойства все более и более приближаются к свойствам жидкостей. Это происходит потому, что с ростом температуры постепенно учащаются перескоки атомов из одного положения равновесия в другое. Определенной температуры плавления у аморфных тел, в отличие от кристаллических, нет. Они не имеют постоянной температуры плавления и обладают текучестью. Аморфные тела изотропны, при низких температурах они ведут себя подобно кристаллическим телам, а при высокой подобны жидкостям.
Задание № 4 работа в группах
Предлагаю вам на опыте убедиться, что кристаллические тела имеют определённую температуру плавления. Проведите исследование изменение со временем температуры веществ. Выяснить какое из тел является кристаллическим, а какое аморфным.
Результаты измерений записать в таблицу. «Приложение 2»
Подведение итогов эксперимента.
Крупные одиночные кристаллы, имеющие свою правильную форму, в природе встречаются очень редко. Но такой кристалл можно вырастить в искусственных условиях. Кристаллизация может происходить из:раствора, расплава, газообразного состояния вещества.
Из раствора кристалл выращивают обычно таким образом
Вначале в воде растворяют достаточное количество кристаллического вещества. При этом раствор подогревают до тех пор, пока вещество полностью не растворится. Затем раствор медленно охлаждают, переводя его тем самым в пересыщенное состояние. В пересыщенный раствор подмешивают затравку. Если, в течение всего времени кристаллизации, поддерживать температуру и плотность раствора одинаковыми во всём объёме, то в процессе роста кристалл примет правильную форму.
Презентация проекта подготовленного учащимися «Выращивание кристаллов»
Первичное закрепление.
Задание № 5 «Проверь себя»
Тест из 5 заданий встроен в презентацию.
Задание № 6 индивидуальная работа
Проверить свои знания по пройденной теме вы сможете, ответив на вопросы теста. При выполнении задания вы можете пользоваться конспектом и учебным информационным модулем «Аморфные и кристаллические тела»
Информационный модуль посвящен теме «Аморфные и кристаллические тела» средней школы. Помимо иллюстрированных гипертекстовых материалов в него входит интерактивная модель «Строение кристаллов»
Тест
Рефлексия
Ваше отношение к уроку ?
Было ли вам интересно на уроке ?
Какую бы вы поставили себе оценку за урок ?
Домашнее задание § 75,76
Дополнительное задание. Создание презентаций «Применение кристаллов в быту», «Самые крупные кристаллы», «Жидкие кристаллы» и др.
Литература
Физика:учебник для 10 класса. Авторы: Г.Я. Мякишев, Б.Б. Буховцев, Н.Н. Соцкий
М.: Просвещение, 2010.
Кристаллы. Леонтьев Павел. http://www.stihi.ru/2001/09/01-282
Модуль содержит ячейки с названиями типа их строения и формулы некоторых веществ. Ученику предлагается распределить предлагаемые вещества по типу их строения путем переноса формулы в соответствующую ячейку.
Информационный модуль посвящен теме «Аморфные и кристаллические тела» средней школы. Помимо иллюстрированных гипертекстовых материалов в него входит интерактивная модель «Строение кристаллов»
Тест , включает 6 интерактивных заданий различных типов с возможностью автоматизированной проверки для аттестации по теме «Аморфные тела. Кристаллические тела» средней школы
Слайд 1
Описание слайда:
Слайд 2

Описание слайда:
Слайд 3

Описание слайда:
Слайд 4

Описание слайда:
Слайд 5

Описание слайда:
Слайд 6

Описание слайда:
Слайд 7

Описание слайда:
Слайд 8

Описание слайда:
Слайд 9

Описание слайда:
Проделаем опыт. Нам понадобятся кусок пластилина, стеариновая свеча и электрокамин. Поставим пластилин и свечу на равных расстояниях от камина. По прошествии некоторого времени часть стеарина расплавится (станет жидкостью), а часть - останется в виде твердого кусочка. Пластилин за то же время лишь немного размягчится. Еще через некоторое время весь стеарин расплавится, а пластилин - постепенно "разъедется" по поверхности стола, все более и более размягчаясь Проделаем опыт. Нам понадобятся кусок пластилина, стеариновая свеча и электрокамин. Поставим пластилин и свечу на равных расстояниях от камина. По прошествии некоторого времени часть стеарина расплавится (станет жидкостью), а часть - останется в виде твердого кусочка. Пластилин за то же время лишь немного размягчится. Еще через некоторое время весь стеарин расплавится, а пластилин - постепенно "разъедется" по поверхности стола, все более и более размягчаясь
Слайд 10

Описание слайда:
Слайд 11

Описание слайда:
Проделаем следующий опыт. В стеклянную воронку бросим кусок смолы или воска и оставим в теплой комнате. По прошествии примерно месяца окажется, что воск принял форму воронки и даже начал вытекать из нее в виде "струи" (см. рисунок). В противоположность кристаллам, которые почти вечно сохраняют собственную форму, аморфные тела даже при невысоких температурах обладают текучестью. Поэтому их можно рассматривать как очень густые и вязкие жидкости. Проделаем следующий опыт. В стеклянную воронку бросим кусок смолы или воска и оставим в теплой комнате. По прошествии примерно месяца окажется, что воск принял форму воронки и даже начал вытекать из нее в виде "струи" (см. рисунок). В противоположность кристаллам, которые почти вечно сохраняют собственную форму, аморфные тела даже при невысоких температурах обладают текучестью. Поэтому их можно рассматривать как очень густые и вязкие жидкости.
Слайд 12

Описание слайда:
Слайд 13

Описание слайда:
Слайд 14

Описание слайда:
Слайд 15

Описание слайда:
Слайд 16

Описание слайда:
Слайд 17

Описание слайда:
Слайд 18

Описание слайда:
Слайд 19

Описание слайда:
Слайд 20

Описание слайда:
Слайд 21

Описание слайда:
Слайд 22

Описание слайда:
Слайд 23

Описание слайда:
Слайд 24

Описание слайда:
Слайд 25

Описание слайда:
Слайд 26

Описание слайда:
Слайд 27

Описание слайда:
Слайд 28

Описание слайда:
Слайд 29

Описание слайда:
Слайд 30

Описание слайда:
Слайд 31

Описание слайда:
Все деформации твёрдых тел сводятся к растяжению (сжатию) и сдвигу. При упругих деформациях форма тела восстанавливается, а при пластических не восстанавливается. Все деформации твёрдых тел сводятся к растяжению (сжатию) и сдвигу. При упругих деформациях форма тела восстанавливается, а при пластических не восстанавливается. Тепловое движение вызывает колебания атомов (или ионов), из которых состоит твёрдое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями, и атомы не покидают своих мест. Поскольку атомы в твёрдом теле связаны между собой, их колебания происходят согласованно, так что по телу с определённой скоростью распространяется волна.
Слайд 33

Описание слайда:
Слайд 34

Описание слайда:
Класс: 10
Тип урока: объяснение нового материала
Цели урока:
- Обучающие: повторить и систематизировать знания о свойствах кристаллов, рассмотреть особенности аморфных тел, провести сравнение, ввести понятия «изотропия», «анизотропия», «поликристалл», «монокристалл».
- Развивающие: развитие интереса к физике и математике, развитие логического мышления, внимания, памяти, самостоятельности при поиске решения.
- Воспитательные: формирование научного мировоззрения, воспитание аккуратности, взаимопомощи.
Средства обучения:
- Учебник «Физика. 10 класс» Генденштейн Л.Э.
- Сборник задач по физике. Генденштейн Л.Э.
- Проектор, компьютер, видеоматериалы (Приложение 1).
- Демонстрационное оборудование – модель кристаллической решетки, образцы кристаллов слюды, кварца.
- Лабораторное оборудование – микроскопы, образцы веществ – соль, сахар, сахарный леденец.
Методы обучения:
- Словесный (объяснение учителя)
- Наглядный (видео)
- Практический (опытное исследование – наблюдение в микроскоп, решение задач)
План урока:
- Орг. момент
- Актуализация и мотивация знаний (повторение)
- Объяснение нового материала
- Закрепление
- Подведение итогов. Домашнее задание
Ход урока
1. Орг. момент.
2. Напомню, что мы продолжаем изучать молекулярно-кинетическую теорию.
– В чем состоит основная задача МКТ? (Ответ: МКТ объясняет свойства макроскопических тел на основе знаний о строении вещества и поведении молекул).
Мы рассмотрели подробно на предыдущих уроках особенности газов и жидкостей. Для завершения МКТ нам необходимо рассмотреть особенности твердых тел.
– Какие особенности о строении твердых тел нам известны из курса физики? (Ответы: молекулы расположены очень близко друг к другу, силы взаимодействия между молекулами велики, молекулы совершаю колебания около своих положений равновесия).
– В чем отличия в строении жидкостей и твердых тел? (Ответ: в силах взаимодействия между молекулами, в расположении частиц, в скоростях и видах движения молекул).
Итак, главная особенность – это правильное расположение атомов, т.е. наличие кристаллической решетки, поэтому большинство твердых тел называют кристаллическими. Однако, существует еще одна группа твердых тел, о которых мы раньше не говорили – это аморфные тела. Итак, тема сегодняшнего урока «Кристаллические и аморфные тела». (Слайд 1) (Приложение 1)
3. Некоторые свойства кристаллов мы знаем. Вспомните, что можно сказать о форме и объеме твердых тел? (Ответ: сохраняются и форма, и объем)
Для систематизации знаний о твердых телах и для сравнения кристаллов и аморфных тел в процессе урока будем заполнять следующую таблицу (таблица приготовлена заранее на доске или можно вывести на экран через компьютер):
Начертите таблицу в тетради.
В колонку «Кристаллические тела» впишите, что нам известно о форме и объеме кристаллических тел.
(Слайд 2)
На рисунке показаны кристаллические решетки различных веществ. Обратите внимание на то, что линии, соединяющие положения атомов, образуют правильные геометрические фигуры: квадраты, прямоугольники, треугольники, 6-угольники и т.д.
Т.е. кристаллы – это твердые тела, атомы которых расположены в определенном порядке (записать в таблицу).
Правильное расположение атомов хорошо демонстрирует модель кристаллической решетки.
Демонстрация модели кристаллической решетки графита.
(Слайд 3) Из уроков химии вы знаете, что кристаллические решетки могут состоять не только из нейтральных атомов, но и из ионов. На рисунке – ионные кристаллические решетки поваренной соли и хлорида цезия. При этом мы опять же наблюдаем правильное расположение частиц в пространстве.
(Слайд 4) Бывает, что одни и те же атомы образуют разные вещества с абсолютно разными свойствами в зависимости от вида кристаллической решетки: слева – слоистая решетка графита (модель которого мы только видели). Графит – мягкое, непрозрачное, проводящее ток вещество. Справа – алмаз с каскадной решеткой, состоящей из тех же атомов углерода. Алмаз – прозрачный кристалл, диэлектрик, самое прочное вещество в природе.
(Слайд 5) Графит и алмаз.
Следствием правильного расположения атомов является наличие плоских граней и правильная геометрическая форма кристаллов (независимо от размера), симметрия. Обратите внимание на это на следующих слайдах:
(Слайд 6) Йодид свинца. Размеры кристалликов разные, а форма повторяется. Кроме того, если кристалл расколется на части, то все они будут такой же формы.
(Слайд 7) Алмазы
(Слайд 9) Снежинки.
(Слайд 10) Кварц.
Исследование. У вас на столе находятся различные вещества и микроскопы. Настройте свет в микроскопе, положите на предметное стеклышко крупинки соли и рассмотрите их. Что из перечисленных уже особенностей кристаллов подтверждается при наблюдении кристалликов соли? (Правильная форма в виде кубиков, видны плоские грани).
Внутри кристалла расстояния между атомами в разных направлениях разные, поэтому и взаимодействия между атомами различны. Давайте подумаем, к чему это приводит.
Еще раз посмотрим на модель решетки графита.
– Где сильнее связаны атомы: в отдельных слоях или между слоями? (Ответ: в отдельных слоях, так как частицы ближе расположены друг к другу).
– Как это может повлиять на прочность кристалла? (Ответ: прочность скорее всего будет отличаться).
– В каком направлении будет быстрее передаваться тепло – вдоль слоя или в перпендикулярном направлении? (Ответ: вдоль слоя) .
Итак, физические свойства различны по разным направлениям. Это называется анизотропией . Запишем в таблицу: кристаллы анизотропны , т.е. их физические свойства зависят от выбранного в кристалле направления (теплопроводность, электропроводность, прочность, оптические свойства). Это основное свойство кристаллов!!
Демонстрация кусочков слюды и ее способности легко расслаиваться, но при этом трудно разорвать пластинку слюды поперек слоев.
(Слайд 11) Рассмотрим еще одну особенность кристаллов.
– Чем отличаются эти два объекта? (Ответ: слева сахар в виде отдельных крупинок, а справа – сросшиеся кристаллики).
Одиночные кристаллы называются монокристаллами , а множество спаянных друг с другом кристалликов – поликристаллы (записать в таблицу).
(Слайд 12) Примеры монокристаллов – драгоценные камни (сапфиры, рубины, алмазы). Так выглядит кристалл рубина в природе.
(Слайд 13) Для ювелирных изделий им придают дополнительную огранку. К поликристаллам относятся все металлы.
(Слайд 14) А здесь сахар в трех состояниях: сахарный песок, сахар-рафинад, и сахарный леденец.
– Есть ли среди этих образцов монокристаллы? (Ответ: сахарный песок) .
– Есть ли среди этих образцов поликристалл? (Ответ: сахар-рафинад) .
– Можем ли мы утверждать, что леденец имеет правильную форму? Есть ли у него плоские грани? (Ответы: нет).
Исследование. Рассмотрите в микроскоп крупинки сахара и кусочки леденца. Что можно сказать о форме крупинок, о наличии плоских граней, о повторяемости формы в разных крупинках? (ответ: у крупинок сахара есть все признаки кристаллов, у крупинок леденца их нет).
(Слайд 15) Вот фотографии, сделанные с помощью микроскопа: слева – крупинка сахарного песка, справа – кусочек леденца. Обратите внимание на скол леденца.
В отличие от кристаллов сахарный леденец может и раскалываться и размягчаться, постепенно переходя в жидкое состояние, при этом меняя форму. Все аморфные тела – это вещества, атомы которых расположены в относительном порядке, нет строгой повторяемости пространственной структуры. (Слайд 16) Следствием этого является изотропия – одинаковые физические свойства по разным направлениям (записать в таблицу).
(Слайд 17) Еще один пример вещества в кристаллическом и аморфном состояниях (песок и стекло). Важно, что из-за разных расстояний между атомами даже в соседних ячейках, разрушаться пространственная решетка не будет при определенной температуре, как это происходит у кристаллов. У аморфных тел существует промежуток температур, при котором вещество плавно переходит в жидкое состояние.
(Слайд 18) Примерами аморфных тел являются смола, канифоль, янтарь, пластилин и другие.
4. Для закрепления материала отвечаем на вопросы № 597, № 598 из сборника задач Рымкевича А.П., № 17.26, 17.30 из сборника задач Генденштейна Л.Э.
Если остается время – решаем задачи из ЕГЭ (А10, А11).
5 . Домашнее задание: заполнить до конца таблицу, §30.
Слайд 1
Кристаллические и аморфные тела
Поверхностное натяжение жидкостей
Слайд 2

Основные состояния вещества
Газообразное
Жидкое
Твердое
Кристаллы Аморфные тела
Любое вещество может находиться в 3-х агрегатных состояниях, в зависимости от условий (температуры и давления)
Плазма
Слайд 3

Кристаллы- твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела (дальний порядок)
Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества.
Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества.
Слайд 4

Кристаллы
Плавятся при определенной температуре (температуре плавления)
Свойства кристалла зависят
от типа кристаллической
решетки
Монокристалл – это одиночный кристалл
Физические свойства:
1)Правильная геометрическая форма
2)Постоянная температура плавления.
Слайд 5

Кристаллические решетки
Молекулярная
Атомная
Металлическая
Ионная
В узлах располагаются молекулы. Между ними действуют слабые силы притяжения, поэтому вещества летучи, у них низкие температуры плавления и кипения, малая твердость. Лед, йод. В узлах находятся отдельные атомы. Связи между ними самые прочные, поэтому вещества самые твердые, в воде не растворяются, у них высокие температуры плавления и кипения. Алмаз (углерод) В узлах находятся атомы металлов, легко переходящие в ионы, при отдаче электронов в общее пользование. Вещества ковкие, пластичные, имеют металлический блеск, высокую тепло- и электропроводность В узлах находятся положительные и отрицательные ионы. Связь между ними прочная, поэтому вещества обладают высокой твердостью, тугоплавкостью, нелетучие, но многие могут растворяться в воде. Хлорид натрия (соль)
Слайд 6

Кристаллы
Слайд 7

Колумбийский изумруд
Шапка Мономаха
Слайд 8

Поликристаллы
Поликристалл висмута
Аметист(разновидность кварца)
Поликристаллы – это твёрдые тела, состоящие из большого числа маленьких кристалликов. Примеры: металлы, кусочек сахара.
Слайд 9

Анизотропия кристалла- зависимость физических свойств от направления внутри кристалла
Различная механическая прочность по разным направлениям (слюда, графит)
Разные тепло – и электро- проводимости
Различные оптические свойства кристалла (разная преломляемость света - кварц)
Все кристаллические тела анизотропны
Слайд 10

Аморфные тела
Это твёрдые тела, где сохраняется только ближний порядок в расположении атомов.
(Кремнезём, смола, стекло, канифоль, сахарный леденец) .
Они не имеют постоянной температуры плавления и обладают текучестью.
При низких температурах они ведут себя подобно кристаллическим телам, а при высокой подобны жидкостям.
Слайд 11

Аморфные тела изотропны, физические свойства одинаковы по всем направлениям
Аморфный, окаменелый древесный сок
Слайд 12

Жидкие кристаллы
Обладают одновременно
свойствами кристалла и
жидкости (анизотропией и текучестью)
Жидкие кристаллы – в основном органические вещества, молекулы которых имеют длинную нитевидную форму или форму плоских пластин
Слайд 13

Жидкости
В жидкостях наблюдается ближний порядок - упорядоченное относительное расположение (или взаимная ориентация в жидких кристаллах) соседних частиц жидкости внутри малых ее объемов
Слайд 14

Жидкости
Строение сходно со строением аморфных тел
Отличие: обладают большой текучестью
Слайд 15

Жидкость
Поверхностные явления – это
явления, связанные с существованием у жидкости свободной поверхности.
Избыточная энергия, которой обладают молекулы поверхностного слоя по сравнению с молекулами в толще жидкости, называется поверхностной (избыточной) энергией.
Удельная поверхностная энергия - отношение поверхностной энергии к площади поверхности σ= Е пов/s
[σ]=1 Дж/м2
Слайд 16

На поверхности жидкости остается такое количество молекул, при котором ее площадь остается минимальной для данного объема жидкости. Капли жидкости принимают форму, близкую к шарообразной, при которой площадь поверхности минимальна. Собственная форма - шарообразная Поверхностное натяжение-явление вызванное притяжением молекул поверхностного слоя к молекулам внутри жидкости. Сила поверхностного натяжения- сила, направленная по касательной к поверхности жидкости, перпендикулярно участку контура, ограничивающего поверхность, в сторону ее сокращения.