Вольфрам, вернее его оксид WO 3 , был открыт Шееле в 1781 г. в минерале тунгстейне, который теперь обычно называют шеелитом (CaWO 4). Вскоре после этого два испанских химика, братья д"Элюяр, установили, что этот же окисел содержится в вольфрамите, где он, однако, связан не с окисью кальция, как в тунгстейне, а с окислами железа и марганца, Вследствие содержания в тунгстейне и в называвшемся в то время "вольфрамом" вольфрамите металл и получил свое название. От первого происходит и применяющееся еще и теперь французами и англичанами название вольфрама - tungsten.
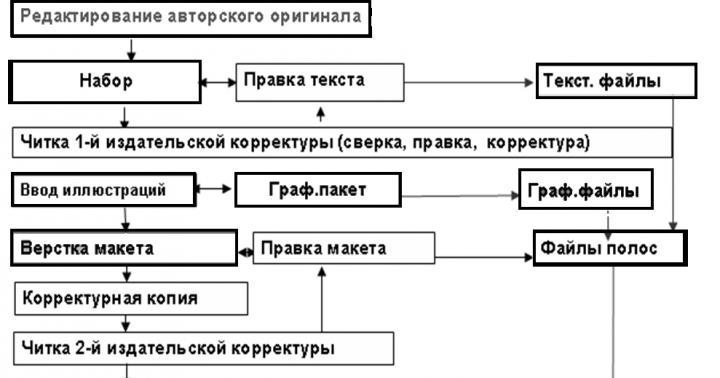
Получение:
Вольфрамовые руды плавят с содой в пламеных печах:
4FeWO 4 + 4Na 2 CO 3 + O 2 =4Na 2 WO 4 + 2Fe 2 O 3 + 4CO 2
Получающийся при этом вольфромат натрия выщелачивают водой и разлагают концентрированной горячей кислотой:
Na 2 WO 4 + 2HCl = H 2 WO 4 + 2NaCl
Образующуюся вольфрамовую кислоту переводят при нагревании в оксид вольфрама(VI), а последний восстанавливают до металла нагреванием с углем или в токе водорода:
H 2 WO 4 = WO 3 + H 2 O;
WO 3 + 3H 2 = W + 3H 2 O
При этом, вследствие очень высокой температуре плавления вольфрама, его получают в виде порошка. Компактный металл получают методами порошковой металлургии.
Физические свойства:
Вольфрамовый порошок матово-серый, плавленый вольфрам - белый и блестящий. Вольфрам обладает самой высокой температурой плавления (Тпл.= 3422°С), плотностью (19,25 г/см 3) и твердостью среди металлов. В тоже время при температуре 1600°С вольфрам очень пластичен, что позволяет вытягивать из него тончайшую вольфрамовую нить.
Химические свойства:
При обычных температурах вольфрам устойчив на воздухе. При нагревании он окисляется в оксид вольфрама(VI). Элементарный азот не реагирует с вольфрамом даже при 1500°С. Водород также поглощается в очень небольших количествах. Из галогенов энергично реагирует фтор, с порошкообразным вольфрамом уже при обычных температурах, хлор реагирует только при температуре красного каления.
Пары воды переводят раскаленный вольфрам в оксид вольфрама(IV). Вольфрам очень устойчив по отношению к кислотам, растворяется только в смеси HF и азотной кислоты. В тоже время, в присутствии окислителей вольфрам активно реагирует с расплавами щелочей: 2W + 4NaOH + 3O 2 =2Na 2 WO 4 + 2H 2 O
В соединениях проявляет степень окисления от +2 до +6, наиболее устойчивы соединения в высшей степени окисления.
Важнейшие соединения:
Оксид вольфрама(VI),
WО 3 , лимонно-желтый хрупкий порошок, который при нагревании становится оранжевым. В воде оксид вольфрама(VI) практически не растворяется, но растворяется в едких щелочах с образованием вольфраматов.
Растворяется в HF с образованием H 2 WF 8 .
Оксид вольфрама(IV),
WО 2 , темно-коричневые кристаллы. Плохо растворим в воде, растворах кислот и щелочей.
Вольфрамовая
(моновольфрамовая) кислота H 2 WO 4 желтые кристаллы или аморфное вещество. Получают действием кислот на вольфраматы. Адсорбент, катализатор гидрогенизации в производстве бензина.
Вольфраматы
- соли вольфрамовой кислоты H 2 WO 4 и поливольфрамовых кислот. Вольфраматы щелочных металлов и аммония растворимы в воде.
Гексафторид вольфрама.
Жидкость с Ткип. 17°С, гидролизуется водой. Используется для нанесения вольфрамовых покрытий, сплавов вольфрама химическим осаждением из газовой фазы, для разделения изотопов вольфрама.
Гексахлорид вольфрама.
кристаллическое вещество, не растворимо в воде, растворимо в спирте, эфире, CS 2 и CCl 4 . Используется для нанесения вольфрамовых покрытий, для получения вольфрама.
Гексакарбонил вольфрама
, W(CO) 6 , кристаллы, возгоняются при 50°С, нерастворимы в воде и кислотах, азотной кислотой разлагаются. Применяют для нанесения покрытий из вольфрама.
Применение:
Вольфрам широко применяют для получения специальных сталей, отличающихся особой твердостью, эластичностью и прочностью. Добавленный вместе с хромом к железу, он дает так называемые быстрорежущие стали, которые сохраняют свою твердость и заточки даже в накаленном состоянии. Вольфрам используется для изготовления нитей накала, катодов в электровакуумных приборах.
См. также:
Вольфрам //Популярная библиотека химических элементов. Издательство «Наука», 1977.
Вольфрам // Википедия. Дата обновления: 12.12.2017. (дата обращения: 20.05.2018).
Вольфрам
ВОЛЬФРА́М -а; м. [нем. Wolfram] Химический элемент (W), тугоплавкий металл серебристо-белого цвета; применяется в металлургии, электротехнике (нити накаливания в электролампах), радиоэлектронике.
◁ Вольфра́мовый, -ая, -ое. В-ая соль. В-ая сталь.
вольфра́м(лат. Wolframium), химический элемент VI группы периодической системы. Название от немецкого Wolf - волк и Rahm - сливки («волчья пена»). Светло-серый металл, наиболее тугоплавкий из металлов, плотность 19,3 г/см 3 , t пл 3380°C. На воздухе при обычной температуре устойчив. Главный минералы - вольфрамит и шеелит. Компонент жаропрочных сверхтвёрдых сталей (инструментальные, быстрорежущие) и сплавов (победит, стеллит и др.); чистый вольфрам используется в электротехнике (нити ламп накаливания) и радиоэлектронике (катоды и аноды электронных приборов).
ВОЛЬФРАМВОЛЬФРА́М (лат. Wolframium), W (читается «вольфрам»), химический элемент с атомным номером 74, атомная масса 183,85. Природный вольфрам состоит из пяти стабильных изотопов 180 W (0,135 масс.%), 182 W (26,41%), 183 W (14,4%), 184 W (30,64%) и 186 W (28,41%).
Конфигурация двух внешних электронных слоев 5s
2
p
6
d
4
6s
2
. Степени окисления от +2 до +6 (валентности II-VI). Расположен в группе VIВ в шестом периоде периодической системы. Радиус атома 0,1368 нм, радиус ионов W 4+ - 0,080 нм, W 6+ - 0,065-0,074 нм. Энергии последовательной ионизации 7,98, 17,7 эВ, сродство к электрону 0,5 эВ.
Электроотрицательность по Полингу 1,7.
История открытия
В 14-16 веках немецкие металлурги при выплавке олова сталкивались с тем, что в ряде случаев при прокаливании оловянной руды с углем большая часть олова оказывается в составе пенистого шлака. Позднее это было объяснено присутствием в оловянной руде SnO 2 (касситерите
) примеси вольфрамита
OsO 4 (Fe,Mn)WO 4 . Название элемента происходит от немецких слов Wolf - волк, Rahm - пена, поскольку он мешал выплавке олова, переводя его в шлак. Оксид вольфрама WO 3 впервые был выделен в 1781 шведским исследователем К. Шееле
. Металлический вольфрам был получен через несколько лет испанскими химиками братьями д"Элуяр.
Нахождение в природе
Вольфрам мало распространен в природе, содержание в земной коре 1,3·10 -4 % по массе. Основные минералы: вольфрамит и шеелит
СaWO 4 , который первоначально называли тунгстен (швед. тяжелый камень). В настоящее время в США, Великобритании и Франции для вольфрама используют название «тангстен» и символ Tu.
Получение
Получая вольфрам, вначале из руд выделяют оксид WO 3 . Затем WO 3 восстанавливают водородом
при нагревании до металлического порошка. Из-за высокой температуры плавления металлического вольфрама получить компактный вольфрам плавлением трудно. Поэтому порошок прессуют, спекают в атмосфере водорода при температуре 1200-1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание его в монолитный материал.
Физические и химические свойства
Вольфрам - светло-серый металл. Решетка кубическая объемно центрированная, а
= 0,31589 нм (a-модификация). Температура плавления 3380 °C (самый тугоплавкий металл), кипения 5900-6000 °C, плотность 19,3 кг/дм 3 .
В атмосфере сухого воздуха вольфрам устойчив до 400 °C, при дальнейшем нагревании образуется оксид WO 3 . При комнатной температуре реагирует только со фтором
. Взаимодействуя со фтором при 300-400 °C, вольфрам образует WF 6 . Существует также образующийся при нагревании высшие хлорид (WCl 6) и бромид (WBr 6) вольфрама. Получены устойчивые галогениды WHal 5 . Устойчивые иодиды в степенях окисления +5 и +6 не получены.
Оксигалогениды WOHal 4 (Hal = F, Cl, Br) получают взаимодействием вольфрама с галогеном при нагревании в присутствии паров воды:
W + H 2 O + 3Cl 2 = WOCl 4 + 2HCl
При взаимодействии вольфрама с парами серы
или с сероводородом
H 2 S при температуре 400 °C образуется дисульфид WS 2 , так же получают диселенид WSe 3 . Нагревая вольфрам в присутствии азота
при температуре 1400-1500 °C получают нитрид вольфрама WN 2 . Синтезированы карбид вольфрама WC и существующий только при высоких температурах карбид W 2 C, дисилицид WSi 2 и пентаборид вольфрама W 2 B 5
Вольфрам не реагирует с минеральными кислотами. Для перевода его в раствор используют смесь азотной HNO 3 и плавиковой HF кислот.
Оксид вольфрама WO 3 обладает кислотными свойствами. Ему отвечает слабая нерастворимая вольфрамовая кислота WO 3 H 2 O (H 2 WO 4). Ее соли - вольфраматы (Na 2 WO 4). Известны высокомолекулярные поливольфраматы (изополивольфраматы, гетерополивольфраматы), анионы которых содержат связанные между собой группировки WO 3 .
Применение
До 50% W используют в производстве легированных сталей. Твердый сплав победит
на 90% состоит из карбида вольфрама WC. Вольфрам - основа нитей ламп накаливания, катодов в электровакуумных приборах, обмоток высокотемпературных печей.
Энциклопедический словарь . 2009 .
Синонимы :Смотреть что такое "вольфрам" в других словарях:
Минерал, открытый в 1785 г., темносерого цвета, очень тяжелый, хрупкий и тугоплавкий. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. ВОЛЬФРАМ металл в виде черного о или… … Словарь иностранных слов русского языка
- (Wolframium), W, химический элемент VI группы периодической системы, атомный номер 74, атомная масса 183,85; самый тугоплавкий металл, температура плавления 3380шC. Вольфрам используют в производстве легированных сталей, твердых сплавов на основе … Современная энциклопедия
Вольфрам - (Wolframium), W, химический элемент VI группы периодической системы, атомный номер 74, атомная масса 183,85; самый тугоплавкий металл, температура плавления 3380°C. Вольфрам используют в производстве легированных сталей, твердых сплавов на основе … Иллюстрированный энциклопедический словарь
- (лат. Wolframium) W, химический элемент VI группы периодической системы, атомный номер 74, атомная масса 183,85. Название от немецкого Wolf волк и Rahm сливки (волчья пена). Светло серый металл, наиболее тугоплавкий из металлов, плотность 19,3… … Большой Энциклопедический словарь
- (символ W), светло серый ПЕРЕХОДНОЙ ЭЛЕМЕНТ. Впервые выделен в 1783 г. Основные источники руды ВОЛЬФРАМИТ и ШЕЕЛИТ. Имеет самую высокую температуру плавления из всех металлов. Применяется в лампах накаливания и в специальных сплавах. КАРБИД… … Научно-технический энциклопедический словарь
W (лат. Wolframium; * a. tungsten; н. Wolfram; ф. tungstene; и. tungsteno), хим. элемент VI группы периодич. системы Mенделеева, ат.н. 74, ат. м. 183,85. Природный B. состоит из смеси пяти стабильных изотопов 180W(0,135%), 182W(26,41 %),… … Геологическая энциклопедия
Тунгстен, звездный металл Словарь русских синонимов. вольфрам сущ., кол во синонимов: 4 звездный металл (1) … Словарь синонимов
Фон Эшенбах (Wolfram von Eschenbach) знаменитыйминезингер, замечательный по глубине мысли и широте пониманиязатрагиваемых его творчеством явлений. В. ф. Э. является собственноединственным из немецких средневековых эпиков, в основу поэм… … Энциклопедия Брокгауза и Ефрона
Вольфрам - представляет собой металл серо стального цвета с высокими значениями плотности и температуры плавления. Он хрупкий, твердый и обладает высокой коррозионной стойкостью. Вольфрам используется для изготовления нитей накала в электрических… … Официальная терминология
вольфрам - tungsten Wolfram хімічний елемент. Символ W, ат. н. 74, ат. маса 183,85. Сріблясто білий метал. Відкритий і виділений у вигляді вольфрамового ангідриду в 1781 р. швед. хіміком К.Шеєле. Найбільш характерними і стійкими є сполуки В. зі ступенем… … Гірничий енциклопедичний словник
ВОЛЬФРАМ, вольфрама, муж. (иностр.) (хим.). Название твердого тугоплавкого металла. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
Книги
- Книга, в которой исчез мир , Вольфрам Флейшгауэр , 1780 год. Время великих философских идей и тайных обществ, мистических лож и таинственных политических организаций. Время, в которое случается многое... Молодой врач из маленького германского… Категория: Боевик Издатель: АСТ, АСТ Москва, Хранитель, Харвест , Производитель:
Из всех используемых на сегодняшний день материалов самым тугоплавким можно назвать вольфрам. Он находится на 74 позиции периодической системы Менделеева, а также обладает множеством сходных особенностей с хромом и молибденом, которые находятся с ним в одной группе. На внешний вид вольфрам представлен в виде твёрдого вещества серого оттенка, с особым серебристым отблеском.
История открытия химического элемента
Вольфрам был открыт шведским химиком Карлом Шееле. Аптекарь по профессии, Шееле в своей маленькой лаборатории провел много замечательных исследований. Он открыл кислород, хлор, барий, марганец. Незадолго до смерти, в 1781 году, Шееле - к этому времени уже член Стокгольмской Академии наук - обнаружил, что минерал тунгстен (впоследствии названный шеелитом) представляет собой соль неизвестной тогда кислоты. Спустя два года испанские химики братья д’Элуяр, работавшие под руководством Шееле, сумели выделить из этого минерала новый элемент - вольфрам, которому суждено было произвести переворот в промышленности. Однако это произошло через целое столетие.
В земной коре такой элемент находится в довольно маленьком количестве. В свободном виде он не встречается и может располагаться лишь в качестве минералов. В промышленном масштабе используют лишь его оксиды .
Характеристики металла
Особенная плотность металла даёт ему необычные характеристики. У него довольно невысокая скорость испарения, высокая точка кипения. По значению электрической проводимости вещество обладает низкими показателями, в отличие от меди сразу в три раза. Именно большой показатель плотности вольфрама ограничивает области его применения. Кроме всего этого, на применение вещества сильно влияет его повышенный показатель ломкости при низкой температуре, неустойчивостью окислению кислородом воздуха при воздействии незначительной температуры.
По внешним особенностям вещество имеет сильные сходства со сталью. Оно используется для активного изготовления различных сплавов, которые характеризуются высокой прочностью. Процесс обработки вольфрама происходит только во время воздействия повышенных температур .
19 300 - это показатель плотность вольфрама кг/м 3 при нормальных условиях использования. Металл способен создавать объёмно-концентрическую кубическую решётку. Обладает неплохим показателем теплоёмкости. Высокий температурный показатель плавления, который доходит до отметки в 3380 градусов Цельсия. На механические особенности оказывает особое влияние его предварительная обработка. Если учитывать то, что плотность вольфрама 20 с 19,3 г/см3, то его можно легко довести до состояния монокристаллического волокна. Такое свойство следует применять во время получения из него особой проволоки . В условиях комнатной температуры металл обладает незначительным показателем пластичности.
Марки элемента
Маркировки бывают следующие:
- Не только показатель вольфрама, но и специальные добавки, применяются в металлургии, а также отражаются на марки такого металла. К примеру, ВА включает в себя полноценную смесь вольфрама с алюминием, а также кремнием. Для получения такой марки характерна повышенная температура начального процесса рекистраллизации, прочность после отжига.
- ВЛ характеризуется добавлением вещества в виде присадки оксида лантана, которая значительно увеличивает эмиссионные показатели металла.
- МВ - это сплав молибдена и вольфрама. Такой состав повышает общую прочность, которая продолжает сохранять особую пластичность металла после отжига.

Основные особенности
Для использования вольфрама в промышленности важно, чтобы он соответствовал таким показателям, как:
- электрическое сопротивление;
- общая температура плавления;
- коэффициент линейного расширения.
Чистое вещество имеет сильную пластичность, а также не может раствориться в специальном растворе кислоты без предварительного нагрева хотя бы до 500 градусов Цельсия. Оно способно очень быстро вступить в полноценную реакцию с углеродом, в результате которой произойдёт образование карбида вольфрама, имеющего высокий показатель прочности. А также такой металл известен своими оксидами, самым распространённым считается вольфрамовый ангидрид. Его главной особенностью можно назвать то, что он может формировать порошок в состояние компактного металла, побочное развитие низших оксидов.
Главные характеристики , которые делают использование вещества затруднительным:
- высокий показатель плотности;
- ломкость, а также склонность к процессу окисления при воздействии низких температур.
Кроме этого, высокий показатель кипения , а также место испарения значительно затрудняют процесс добычи полезного металла и материалов из него.

Использование вольфрама
Использование вольфрама встречается в следующих областях:
- Жаропрочные и износостойкие сплавы основываются на тугоплавкости вещества. В промышленности такие соединения химического вещества используются с хромом и кобальтом, которые по-другому именуются стеллитами. Их путём наплавки наносят на изнашиваемую область деталей у промышленных автомобилей.
- Тяжёлые и контактные сплавы - это смеси из серебра, меди, а также вольфрама. Их можно назвать очень эффективными контактными компонентами, именно по этой причине и применяются для производства рабочих деталей рубильников, электродов для создания точечной сварки, а также изготовления выключателей.
- В качестве проволоки, кованных изделий, а также ленты вольфрам используется в радиотехнике, в создании специальных электрических ламп, а также рентгенотехники. Именно такой химический элемент считается наилучшим металлом для изготовления спиралей, а также особых нитей для накаливания.
- Вольфрамовые прутики и проволока нужны для создания специальных электрических нагревателей для печей высокотемпературного типа. Нагреватели из вольфрама могут работать в атмосфере инертного газа, в вакууме, а также в водороде.

Сплавы, которые включают в себя вольфрам
На сегодняшний день можно найти большое количество однофазных сплавов из вольфрама. Это подразумевает использование как одного, так и сразу нескольких компонентов. Наибольшей популярностью пользуются соединения вольфрама, а также молибдена. Легирование таким веществам значительно повышает общую прочность вольфрама во время его активного растяжения. А также к однофазным сплавам можно отнести такие системы, как: графий, ниобий, цирконий.
Но при этом наибольшую пластичность элементу может придать рений, который сохраняет остальные показатели на характерном для него уровне. Но практическое использование такого соединения ограниченно особыми проблемами и в процессе добычи Re.
Так как металл можно назвать наиболее тугоплавким веществом, получить такие сплавы очень трудно традиционным путём. При температуре плавления вольфрама остальные металлы начинают активно закипать, а в некоторых случаях доходят до газообразного состояния. Современные технологии помогают получать большое число сплавов при помощи технологии электролиза. К примеру, вольфрам - никель - кобальт, который применяется не для изготовления целых деталей, а для того, чтобы нанести дополнительный слой защиты на менее прочные материалы и поверхности.
А также в промышленности всё ещё популярен метод получения вольфрамовых сплавов, которые применяют методы порошковой металлургии. В это время стоит создавать особые условия для протекания технологических процессов, который будет включать в себя наличие специального вакуума. Особенности взаимодействия остальных металлов и вольфрама делают наиболее предпочтительными соединения не парного типа, а с применением 3, 4-х и большего числа веществ.
Такие необычные сплавы будут отличаться от остальных особой прочностью и твёрдостью, но малейшее отклонение от процентного содержания веществ в металле того либо другого элемента может привести к развитию особой хрупкости у полученного сплава.
Способы получения вещества
Вольфрам, как и большое количество других элементов из редкой группы, нельзя просто так найти в природе. Именно по этой причине добыча такого металла не применяется в строительстве больших промышленных зданий. Сам процесс получения такого металла условно разделён на несколько стадий:
- добыча руды, которая включает в свой состав такой редкий металл;
- создание полноценных условий для дальнейшего выделения вольфрама из перерабатываемых компонентов;
- концентрирование материала в качестве раствора или же осадка;
- процесс очищения полученного вида химического соединения;
- процесс получения более чистого вещества.
Более сложным будет процесс изготовления компактного материала, например, вольфрамовой проволоки. Главная трудность такого вещества будет заключена в том, что запрещено допускать даже малейшее попадание в него особых примесей, которые способны резко ухудшить плавкие свойства и прочность металла.

При помощи такого металла происходит активное создание нити накаливания, нагревателей, экраны вакуумных печей, рентгеновские трубки, которые нужны для использования в условиях повышенной температуры.

Сталь, легированная вольфрамом, обладает высокими качествами прочности. Готовая продукция из таких разновидностей сплавов применяется для создания инструментов широкого использования: бурение скважин, медицина, изделия для качественной обработки материалов в процессе машиностроения (особые режущие пластины). Главным достоинством таких соединений станет особая устойчивость к истиранию, небольшая вероятность развития трещин во время эксплуатации вещи. Самой известной в процессе строительства считается марка стали с применением вольфрама, которая имеет название победит.
Химическая промышленность также нашла в себе место для использования металла. Из него можно производить краски, пигменты и катализаторы.
Атомная промышленность применяет тигли из этого металла, а также специализированные контейнеры для хранения наиболее радиоактивных отходов.
О нанесении покрытия из элемента уже было указано выше. Оно используется для нанесения на такие материалы, которые работают при воздействии высоких температур в восстановительной, а также нейтральной среде, как специальная защитная плёнка.
А также есть такие прутки, которые применяются и в других сварках. Так как вольфрам неизменно продолжает оставаться самым тугоплавким металлом, то во время проведения сварочных работ он применяется со специальными присадочными проволоками.
Вольфрам в быту можно применять, главным образом, в электротехнической цели.
Именно его стоит использовать в качестве основного компонента (легирующий элемент) в процессе производства быстрорежущей стали. В среднем показатель содержания вольфрама варьируется от девяти до двадцати процентов. Кроме всего этого, он находится в составе инструментальной стали.
Такие разновидности стали используются во время производства свёрл, штампов, пуансонов и фрез. К примеру, быстрорежущие стали P6 M5 говорят о том, что сталь была легирована молибденом и кобальтом. Кроме этого, вольфрам включает в себя магнитные стали, которые стоит разделять на вольфрамокобальтовые и вольфрамовые разновидности.
Вещество в повседневной жизни в чистом виде почти невозможно встретить. Карбид вольфрама представлен в качестве соединения металла с углеродом. Соединение таких веществ отличается высокой твёрдостью, износостойкостью, а также тугоплавкостью. На базе карбида вольфрама можно создавать инструментальные, производительные твёрдые сплавы , которые имеют около 90 процентов вольфрама и около 10 процентов кобальта. Из твёрдых сплавов можно изготавливать режущие части как бугровых, так и режущих инструментов.
Главная область использования вольфрама - это сварка металлов. Из сварки можно создавать особые электроды, которые используют для другого типа сплавки. Получаемые электроды можно назвать неплавящимися.
Видео
Интересные факты о вольфраме вы можете узнать из этого видео.
Мировое производство вольфрама - примерно 32 тыс. т в год. С начала нашего века оно не раз испытывало резкие взлеты и столь же крутые спады. На диаграмме видно, что пики на кривой производства в точности отвечают кульминационным моментам первой и второй мировых войн. И сейчас вольфрам является сугубо стратегическим металлом
Диаграмма мирового производства вольфрама (в тыс. т) в первой половине XX в.
Из вольфрамовой стали и других сплавов, содержащих вольфрам или его карбиды, изготовляют танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей.
Вольфрам - непременная составная часть лучших марок инструментальной стали. В целом металлургия поглощает почти 95% всего добываемого вольфрама. (Характерно, что она широко использует не только чистый вольфрам, но главным образом более дешевый ферровольфрам - сплав, содержащий 80% W и около 20% Fe; получают его в электродуговых печах).
Вольфрамовые сплавы обладают многими замечательными качествами. Так называемый тяжелый металл (из вольфрама, никеля и меди) служит для изготовления контейнеров, в которых хранят радиоактивные вещества. Его защитное действие на 40% выше, чем у свинца. Этот сплав применяют и при радиотерапии, так как он создает достаточную защиту при сравнительно небольшой толщине экрана.
Сплав карбида вольфрама с 16% кобальта настолько тверд, что может частично заменить алмаз при бурении скважин.
Псевдосплавы вольфрама с медью и серебром - превосходный материал для рубильников и выключателей электрического тока высокого напряжения: они служат в шесть раз дольше обычных медных контактов.
О применении вольфрама в волосках электроламп говорилось в начале статьи. Незаменимость вольфрама в этой области объясняется не только его тугоплавкостью, но и пластичностью. Из одного килограмма вольфрама вытягивается проволока длиной 3,5 км, т.е. этого килограмма достаточно для изготовления нитей накаливания 23 тыс. 60-ваттных лампочек. Именно благодаря этому свойству мировая электротехническая промышленность потребляет всего около 100 т вольфрама в год.
В последние годы важное практическое значение приобрели химические соединения вольфрама. В частности, фосфорно-вольфрамовая гетерополикислота применяется для производства лаков и ярких, устойчивых на свету красок. Раствор вольфрамата натрия Na2WO4 придает тканям огнестойкость и водонепроницаемость, а вольфраматы щелочноземельных металлов, кадмия и редкоземельных элементов применяются при изготовлении лазеров и светящихся красок.
Прошлое и настоящее вольфрама дают все основания считать его металлом-тружеником.
Химия
Элемент № 74 вольфрам причисляют обычно к редким металлам: его содержание в земной коре оценивается в 0,0055%; его нет в морской воде, его не удалось обнаружить в солнечном спектре. Однако по популярности онможет поспорить со многими отнюдь не редкими металлами, а его минералы были известны задолго до открытия самого элемента. Так, еще в XVII в. во многих европейских странах знали «вольфрам» и «тунгстен» - так называли тогда наиболее распространенные минералы вольфрама - вольфрамит и шеелит. А элементарный вольфрам был открыт в последней четверти XVIII в .
Вольфрамовая руда
Очень скоро этот металл получил практическое значение - как легирующая добавка. А после Всемирной выставки 1900 г. в Париже, на которой демонстрировались образцы быстрорежущей вольфрамовой стали, элемент № 74 стали применять металлурги во всех более или менее промышленно развитых странах. Главная особенность вольфрама как легирующей добавки заключается в том, что он придает стали красностойкость - позволяет сохранить твердость и прочность при высокой температуре. Более того, большинство сталей при охлаждении на воздухе (после выдержки при температуре, близкой к температуре красного каления) теряют твердость. А вольфрамовые - нет.
Инструмент, изготовленный из вольфрамовой стали, выдерживает огромные скорости самых интенсивных процессов металлообработки. Скорость резания таким инструментом измеряется десятками метров в секунду.
Современные быстрорежущие стали содержат до 18% вольфрама (или вольфрама с молибденом), 2-7% хрома и небольшое количество кобальта. Они сохраняют твердость при 700-800° С, в то время как обычная сталь начинает размягчаться при нагреве всего до 200° С. Еще большей твердостью обладают «стеллиты» - сплавы
вольфрам
а с хромом и кобальтом (без железа) и особенно карбиды вольфрама - его соединения с углеродом. Сплав «видна» (карбид вольфрама, 5-15% кобальта и небольшая примесь карбида титана) в 1,3 раза тверже обычной вольфрамовой стали и сохраняет твердость до 1000- 1100° С. Резцами из этого сплава можно снимать за минуту до 1500-2000 м железной стружки. Ими можно быстро и точно обрабатывать «капризные» материалы: бронзу и фарфор, стекло и эбонит; при этом сам инструмент изнашивается совсем незначительно.
В начале XX в. вольфрамовую нить стали применять в электрических лампочках: она позволяет доводить накал до 2200° С и обладает большой светоотдачей. И в этом качестве вольфрам совершенно незаменим до наших дней. Очевидно, поэтому электрическая лампочка названа в одной популярной песне «глазком вольфрамовым».
Минералы и руды вольфрама
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисыо вольфрама WO 3 и окислами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Наиболее распространенный минерал, вольфрамит, представляет собой твердый раствор вольфраматов (солей вольфрамовой кислоты) железа и марганца (mFeW0 4 *nMnW0 4). Этот раствор - тяжелые и твердые кристаллы коричневого или черного цвета, в зависимости от того, какое соединение преобладает в их составе. Если больше побнерита (соединения марганца), кристаллы черные, если же преобладает железосодержащий ферберит - коричневые. Вольфрамит парамагнитен и хорошо проводит электрический ток.
Из других минералов вольфрама промышленное значение имеет шеелит - вольфрамат кальция CaW04. Он образует блестящие, как стекло, кристаллы светло-желтого, иногда почти белого цвета. Шеелит немагнитен, но он обладает другой характерной особенностью - способностью к люминесценции. Если его осветить ультрафиолетовыми лучами, он флуоресцирует в темноте ярко-синим цветом. Примесь молибдена меняет окраску свечения шеелита: она становится бледно-синей, а иногда даже кремовой. Это свойство шеелита, используемое в геологической разведке, служит поисковым признаком, позволяющим обнаружить залежи минерала.
Месторождения вольфрамовых руд теологически связаны с областями распространения гранитов . Крупнейшие зарубежные месторождения вольфрамита и шеелита находятся в Китае, Бирме, США, Боливии и Португалии. Наша страна тоже располагает значительными запасами минералов вольфрама, главные их месторождения находятся на Урале, Кавказе и в Забайкалье.
Крупные кристаллы вольфрамита или шеелита - большая редкость. Обычно вольфрамовые минералы лишь вкраплены в древние гранитные породы - средняя концентрация вольфрама в итоге оказывается в лучшем случае 1-2%. Поэтому извлечь вольфрам из руд очень трудно.
Как получают вольфрам
Первая стадия - обогащение руды, отделение ценных компонентов от основной массы - пустой породы. Методы обогащения - обычные для тяжелых руд и металлов: измельчение и флотация с последующими операциями - магнитной сепарацией (для вольфрамитиых руд) и окислительным обжигом.
Полученный концентрат чаще всего спекают с избытком соды, чтобы перевести вольфрам в растворимое соединение - вольфрамат натрия. Другой способ получения этого вещества - выщелачивание; вольфрам извлекают содовым раствором под давлением и при повышенной температуре (процесс идет в автоклаве) с последующей нейтрализацией и осаждением в виде искусственного шеелита, т. е. вольфрамата кальция. Стремление получить именно вольфрамат объясняется тем, что из него сравнительно просто, всего в две стадии:
CaW0 4 → H 2 W0 4 или (NH 4) 2 W0 4 → WO 3 , можно выделить очищенную от большей части примесей окись вольфрама.
Есть еще один способ получения окиси вольфрама - через хлориды. Вольфрамовый концентрат при повышенной температуре обрабатывают газообразным хлором. Образовавшиеся хлориды вольфрама довольно легко отделить от хлоридов других металлов методом возгонки, используя разницу температур, при которых эти вещества переходят в парообразное состояние. Полученные хлориды вольфрама можно превратить в окисел, а можно пустить непосредственно на переработку в элементарный металл.
Превращение окислов или хлоридов в металл - следующая стадия производства вольфрама. Лучший восстановитель окиси вольфрама - водород. При восстановлении водородом получается наиболее чистый металлический вольфрам. Процесс восстановления происходит в трубчатых печах, нагретых таким образом, что по мере продвижения по трубе «лодочка» с W0 3 проходит через несколько температурных зон. Навстречу ей идет поток сухого водорода. Восстановление происходит и в «холодных» (450-600° С) и в «горячих» (750-1100° С) зонах; в «холодных» - до низшего окисла W0 2 , дальше - до элементарного металла. В зависимости от температуры и длительности реакции в «горячей» зоне меняются чистота и размеры зерен выделяющегося на стенках «лодочки» порошкообразного вольфрама.
Восстановление может идти не только под действием водорода. На практике часто используется уголь. Применение твердого восстановителя несколько упрощает производство, однако в этом случае требуется более высокая температура - до 1300-1400° С. Кроме того, уголь и примеси, которые он всегда содержит, вступают в реакции с вольфрамом, образуя карбиды и другие соединения. Это приводит к загрязнению металла. Между тем электротехнике нужен весьма чистый вольфрам. Всего 0,1% железа делает вольфрам хрупким и малопригодным для изготовления тончайшей проволоки.
Получение вольфрама из хлоридов основано на процессе пиролиза. Вольфрам образует с хлором несколько соединений. С помощью избытка хлора все их можно перевести в высший хлорид - WCl 6 , который разлагается на вольфрам и хлор при 1600° С. В присутствии водорода этот процесс идет уже при 1000° С.
Так получают металлический вольфрам, но не компактный, а в виде порошка, который затем прессуют в токе водорода при высокой температуре. На первой стадии прессования (при нагреве до 1100-1300° С) образуется пористый ломкий слиток. Прессование продолжается при еще более высокой температуре, едва не достигающей под конец температуры плавления вольфрама. В этих условиях металл постепенно становится сплошным, приобретает волокнистую структуру, а с ней - пластичность и ковкость.
Главные свойства
Вольфрам отличается от всех остальных металлов особой тяжестью, твердостью и тугоплавкостью. Давно известно выражение: «Тяжелый, как свинец». Правильнее было бы говорить: «Тяжелый, как вольфрам». Плотность вольфрама почти вдвое больше, чем свинца, точнее - в 1,7 раза. При этом атомная масса его несколько ниже: 184 против 207.
По тугоплавкости и твердости вольфрам и его сплавы занимают высшие места среди металлов. Технически чистый вольфрам плавится при 3410° С, а кипит лишь при 6690° С. Такая температура - на поверхности Солнца!
А выглядит «король тугоплавкости» довольно заурядно. Цвет вольфрама в значительной мере зависит от способа получения. Сплавленный вольфрам - блестящий серый металл, больше всего напоминающий платину. Вольфрамовый порошок - серый, темно-серый и даже черный (чем мельче зернение, тем темнее).
Химическая активность
Природный вольфрам состоит из пяти стабильных изотопов с массовыми числами от 180 до 186. Кроме того, в атомных реакторах в результате различных ядерных реакций образуются еще 8 радиоактивных изотопов вольфрама с массовыми числами от 176 до 188; все они сравнительно недолговечны: их периоды полураспада - от нескольких часов до нескольких месяцев.
Семьдесят четыре электрона атома вольфрама расположены вокруг ядра таким образом, что шесть из них находятся на внешних орбитах и могут быть отделены сравнительно легко. Поэтому максимальная валентность вольфрама равна шести. Однако строение этих внешних орбит особое - они состоят как бы из двух «ярусов»: четыре электрона принадлежат предпоследнему уровню -d, который оказывается, таким образом, заполненным меньше чем наполовину. (Известно, что число электронов в заполненном уровне d равно десяти.) Эти четыре электрона (очевидно, неспарепные) способны легко образовывать химическую связь. Что же касается двух «самых наружных» электронов, то их оторвать совсем легко.
Именно особенностями строения электронной оболочки объясняется высокая химическая активность вольфрама. В соединениях он бывает не только шестивалентным, но и пяти-, четырех-, трех-, двух- и нульвалентным. (Неизвестны лишь соединения одновалентного вольфрама).
Активность вольфрама проявляется в том, что он вступает в реакции с подавляющим болишинстом элементов, образуя множество простых и сложных соединений. Даже в сплавах вольфрам часто оказывается химически связанным. А с кислородом и другими окислителями он взаимодействует легче, чем большинство тяжелых металлов.
Реакция вольфрама с кислородом идет при нагревании, особенно легко - в присутствии паров воды. Если вольфрам нагревать на воздухе, то при 400-500° С на поверхности металла образуется устойчивый низший окисел W0 2 ; вся поверхность затягивается коричневой пленкой. При более высокой температуре сначала получается промежуточный окисел W 4 O 11 синего цвета, а затем лимонножелтая трехокись вольфрама W0 3 , которая возгоняется при 923° С.
Сухой фтор соединяется с тонкоизмельченным вольфрамом уже при небольшом нагревании. При этом образуется гексафторид WF6 - вещество, которое плавится при 2,5° С и кипит при 19,5° С. Аналогичное соединение - WCl 6 - получается при реакции с хлором, но лишь при 600° С. Сине-стального цвета кристаллы WCl 6 плавятся при 275° С и кипят при 347° С. С бромом и йодом вольфрам образует малоустойчивые соединения: пента- и дибромид, тетра- и дииоднд.
При высокой температуре вольфрам соединяется с серой, селеном и теллуром, с азотом и бором, с углеродом и кремнием. Некоторые из этих соединений отличаются большой твердостью и другими замечательными свойствами.
Очень интересен карбонил W(CO) 6 . Здесь вольфрам соединен с окисью углерода и, следовательно, обладает нулевой валентностью. Карбонил вольфрама неустойчив; его получают в специальных условиях. При 0° он выделяется из соответствующего раствора в виде бесцветных кристаллов, при 50° С возгоняется, а при 100° С полностью разлагается. Но именно это соединение позволяет получить тонкие и плотные покрытия из чистого вольфрама.
Не только сам вольфрам, но и многие его соединения весьма активны. В частности, окись вольфрама WO 3 способна к полимеризации. В результате образуются так называемые изополисоединения и гетерополисоединения: молекулы последних могут содержать более 50 атомов.
Сплавы
Почти со всеми металлами вольфрам образует сплавы, однако получить их не так-то просто. Дело в том, что общепринятые методы сплавления в данном случае, как правило, неприменимы. При температуре плавления вольфрама большинство других металлов уже превращается в газы пли весьма летучие жидкости. Поэтому сплавы, содержащие вольфрам, обычно получают методами порошковой металлургии.
Во избежание окисления все операции проводят в вакууме или в атмосфере аргона. Делается это так. Сначала смесь металлических порошков прессуют, затем спекают и подвергают дуговой плавке в электрических печах. Иногда прессуют и спекают один вольфрамовый порошок, а полученную таким путем пористую заготовку пропитывают жидким расплавом другого металла: получаются так называемые псевдосплавы. Этим методом пользуются, когда нужно получить сплав вольфрама с медью и серебром.
С хромом и молибденом, ниобием и танталом вольфрам дает обычные (гомогенные) сплавы при любых соотношениях. Уже небольшие добавки вольфрама повышают твердость этих металлов и их устойчивость к окислению.
Сплавы с железом, никелем и кобальтом более сложны. Здесь, в зависимости от соотношения компонентов, образуются либо твердые растворы, либо интерметаллические соединения (химические соединения металлов), а в присутствии углерода (который всегда имеется в стали) - смешанные карбиды вольфрама и железа, придающие металлу еще большую твердость.
Очень сложные соединения образуются при сплавлении вольфрама с алюминием, бериллием и титаном: в них на один атом вольфрама приходится от 2 до 12 атомов легкого металла. Эти сплавы отличаются жаропрочностью и устойчивостью к окислению при высокой температуре.
На практике чаще всего применяются сплавы вольфрама не с одним каким-либо металлом, а с несколькими. Таковы, в частности, кислотостойкие сплавы вольфрама с хромом и кобальтом или никелем (амалой); из них делают хирургические инструменты. Лучшие марки магнитной стали содержат вольфрам, железо и кобальт. А в специальных жаропрочных сплавах, кроме вольфрама, имеются хром, никель и алюминий.
Из всех сплавов вольфрама наибольшее значение приобрели вольфрамсодержащие стали. Они устойчивы к истиранию, не дают трещин, сохраняют твердость вплоть до температуры красного каления. Инструмент из них не только позволяет резко интенсифицировать процессы металлообработки (скорость обработки металлических изделий повышается в 10-15 раз), но и служит намного дольше, чем тот же инструмент из другой стали.
Вольфрамовые сплавы не только жаропрочны, но и жаростойки. Они не корродируют при высокой температуре под действием воздуха, влаги и различных химических реагентов. В частности, 10% вольфрама, введенного в никель, достаточно, чтобы повысить коррозионную устойчивость последнего в 12 раз! А карбиды вольфрама с добавкой карбидов тантала и титана, сцементированные кобальтом, устойчивы к действию многих кислот - азотной, серной и соляной - даже при кипячении. Им опасна только смесь плавиковой и азотной кислот.